- Accueil
- ACCUEIL
- SANTÉ
- La consommation du tangawisi protège contre les cancers et les maladies cardiovasculaires
La consommation du tangawisi protège contre les cancers et les maladies cardiovasculaires

Le gingembre est une plante de la famille des zingibéracées, cultivée dans les pays chauds pour sa racine (rhizome), il est surtout connu pour ses effets aphrodisiaques et sa capacité de stimulant sexuel. Mais cette vertu n’est pas la seule, et de loin...
Qualité hygiénique des boissons Tangawisi fabriq?uées et vendues à Kinshasa et perspectives de leur amélioration.
Vawazola N. V. H.*, Tshiendesha K. C., Ntumba D., Kilemba N., Masimango N. J.-T
Le 17/12/2018
 ?
?
Introduction
Chez la majorité des populations africaines, il existe des breuvages préparés à base de certaines plantes consommés pour diverses raisons, y compris thérapeutiques. La qualité hygiénique des boissons produites artisanalement et vendues sur les places publiques laisse souvent à désirer. Généralement ces boissons accusent une forte contamination d’origine microbienne
[FRANÇOISE, 1995 ; ANONYME, 1997].
Les boissons Tangawisi sont un des produits Tangawisi de fabrication locale vendues sur la voie publique à Kinshasa, Capitale de la République Démocratique du Congo. Elles sont obtenues par extraction, dans l’eau, des broyats des organes d’espèces végétales (écorce, racine, graine, fruit) à vertu médicinale, répertoriées dans des pharmacopées [LATHAM et KONDA, 2006 ; SCHMELZER et GURIB-FAKIM, 2008 ; KAMBU, 1990 ; NZUKI et al., 2013 ; NGBOLUA et al., 2016]. Les boissons Tangawisi sont loin d’échapper aux contaminations microbiennes étant donné les installations dans lesquelles elles sont produites et les conditions précaires d’hygiène environnementale qui entourent leur élaboration.
Les boissons Tangawisi sont censées contenir diverses substances chimiques, en particulier les métabolites secondaires de plantes ou substances bioactives telles que les polyphénols, les stéroïdes, les terpénoïdes, les quinones, les saponines, les flavonoïdes, les alcaloïdes, les tanins… auxquelles certains auteurs attribuent des propriétés thérapeutiques et protectrices qui vont de l’inhibition de l’inflammation jusqu’aux effets anticancérogènes [BRUNETON, 1999 ; GAZENGEL et ORECCHIONI, 2001 ; REICHL, 2002 ; KAMBU, 1990]. L’opinion populaire leur attribue un pouvoir aphrodisiaque.
Aussi, ces boissons connaissent-elles un succès relatif au niveau des couches de la population les plus démunies, parfois au détriment des produits thérapeutiques modernes, mais la présence des germes microbiens peut exposer les consommateurs à des risques des toxi-infections alimentaires susceptibles d’annihiler le bienfait attendu des substances que ces boissons sont censées leur apporter. La littérature ne fournit pas de données relatives à la qualité hygiénique des boissons Tangawisi ainsi qu’à leur composition chimique.
L’objectif du présent travail est de mettre en évidence la qualité hygiénique de quelques boissons Tangawisi fabriquées et vendues à Kinshasa et de proposer des perspectives en vue de leur amélioration.
MATÉRIEL ET MÉTHODES
Matériel
Le matériel est constitué de six (6) boissons Tangawisi : cinq boissons (I, II, III, IV et V) ont été obtenues auprès de certains fabricants et une sixième boisson formulée a été fabriquée par nos soins au Laboratoire de Chimie et Industries Agricoles de la Faculté des Sciences Agronomiques de l’Université de Kinshasa.
Méthodes
Détermination de la qualité hygiénique de quatre boissons Tangawisi
Pour cette détermination, des analyses microbiologiques ont été effectuées avec les dilutions des 4 boissons (I, II, III et boisson formulée) : le dénombrement des germes aérobies mésophiles totaux sur le milieu Plate Count agar après 24 heures d’incubation à 37°C, le dénombrement des coliformes par la méthode du nombre le plus probable sur le bouillon de MacConkey incubé à 37°C pendant 24 heures pour les coliformes totaux et à 44°C pour les coliformes fécaux, le dénombrement des entérobactéries pathogènes sur le milieu de MacConkey au cristal violet après incubation à 37°C, le dénombrement de la flore fongique sur le milieu de Sabouraud dextrose agar 2% après 48 heures d’incubation à 37°C, le dénombrement de la flore lactique sur le milieu MRS additionné de l’actidione après 72 heures d’incubation à 37°C dans une jarre d’anaérobiose sous atmosphère enrichie en CO2, le dénombrement de la flore mannitol positif et des staphylocoques sur le milieu Mannitol salt agar après 24 heures d’incubation à 37°C et le dénombrement des streptocoques fécaux sur le milieu de Slanetz après 48 heures d’incubation à 44°C [DAHOUENON-AHOUSSI et al., 2012 ; NDIAYE et al., 2015]. Une colonie caractéristique des coliformes fécaux développée sur le milieu MacConkey agar au cristal violet et quelques colonies isolées sur les milieux XLD agar et SS agar après enrichissement de 1 ml de la boisson II sur le bouillon au sélénite ont été soumises à une galerie des tests biochimiques pour leur identification par similarité. Cette galerie était constituée des tests suivants: test de Kligler, test de citrate, test de mobilité-indole-lysine, test d’uréase et test d’oxydase.
Phénomènes observés lors de la maturation d’une boisson Tangawisi
La boisson I a fait l’objet des observations pendant 7 jours après sa préparation dans le but de suivre l’évolution des paramètres physico-chimiques et des paramètres microbiologiques. Pour les paramètres physico-chimiques : le pH a été mesuré à l’aide d’un pH-mètre (Consort C532), le degré alcoolique et l’extrait réel ont été obtenus sur la table de Reichard et Steinbeck à partir de la densité du distillat (pour le degré alcoolique) et la densité du résidu (pour l’extrait réel), la densité primitive a été calculée par la formule de Balling prenant en compte le degré alcoolique et l’extrait réel [DAHOUENON-AHOUSSI et al., 2012], les protéines brutes ont été dosées par la méthode Kjeldahl [SAEZ-PLAZA et al., 2013], les sucres totaux ont été mesurés à l’aide d’un réfractomètre à main (VWR versioin1) et les sucres réducteurs ont été dosés par la méthode de Fehling [DAHOUENON-AHOUSSI et al., 2012 ; WOLDU et TSIGIE, 2015]. Pour les paramètres microbiologiques, les germes totaux, les coliformes totaux et fécaux, la flore fongique, la flore mannitol positif et les streptocoques fécaux ont été dénombrés ; une colonie caractéristique développée sur Chromatic-Salmonella agar a été soumise à la coloration Gram et à une série de tests biochimiques de la galerie Enterosystème18R pour l’identification (Liofilchem LIO-11613).
Essai de pasteurisation des deux boissons Tangawisi
L’essai de pasteurisation a porté sur deux boissons Tangawisi (IV et V) acquises auprès de deux fabricants. Deux traitements de pasteurisation ont été appliqués : pasteurisation basse (TB) à 60-62°C pendant 30 minutes et pasteurisation haute (TH) à 72-75°C pendant 5 minutes. Les dénombrements des germes totaux sur gélose nutritive et des coliformes totaux ont été réalisés : immédiatement après traitement (analyse 1), 2 semaines (analyse 2) et quatre semaines (analyse 3) après. Ces analyses ont permis de comparer la qualité hygiénique des boissons traitées par rapport aux non traitées.
Essai de séchage de broyat des végétaux d’une boisson Tangawisi
Les végétaux d’une boisson Tangawisi fournis par un fabricant ont été broyés. Le broyat obtenu a été subdivisé en trois parties : une part non séchée a servi à la fabrication d’une boisson Tangawisi et les deux autres ont été séchées, l’une à l’étuve à 60°C et l’autre au soleil. Après séchage, les deux broyats ont été macérés dans l’eau pour l’obtention des deux boissons. La couleur, l’odeur et le goût des trois boissons ont été appréciés.
RÉSULTATS
Qualité hygiénique de quatre boissons Tangawisi
Les études sur la qualité microbiologique menées sur quatre boissons Tangawisi (trois boissons achetées à Kinshasa et une boisson fabriquée par nos soins au laboratoire) montrent que leur qualité hygiénique laisse à désirer car elles sont colonisées par des groupes de microorganismes tels que des bactéries, des levures et des moisissures. Le Tableau 1 donne le nombre d’unités formant colonies (UFC) de certaines flores microbiennes et le nombre le plus probable (NPP) des coliformes totaux et fécaux dénombrés sur les quatre boissons Tangawisi.
Tableau 1| Dénombrement de la flore microbienne contaminant 4 boissons Tangawisi
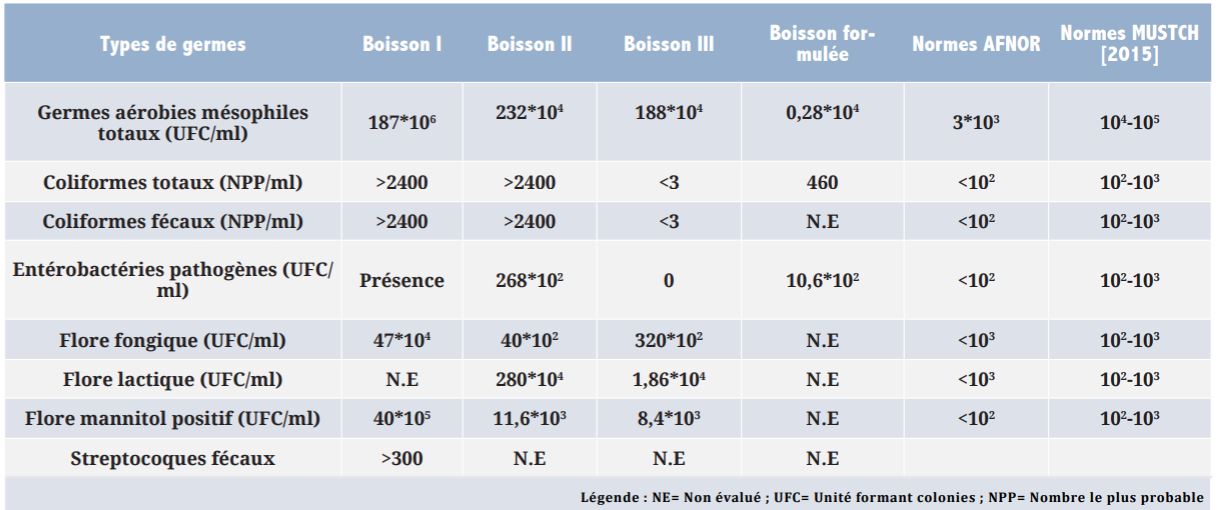
Tableau 2| Evolution de quelques paramètres physico-chimiques de la boisson Tangawisi I en maturation
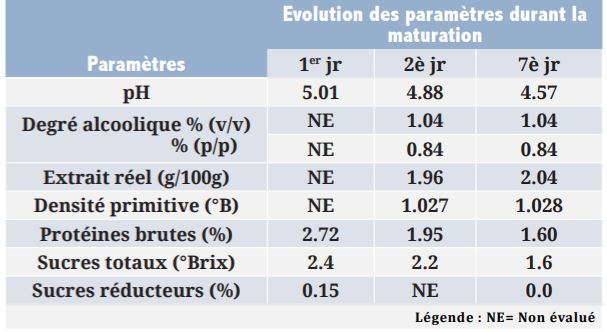
Tableau 3| Evolution du nombre d’unités formant colonies (UFC) de la flore microbienne de la boisson Tangawisi I en maturation

Phénomènes observés au cours de la maturation de la boisson Tangawisi
Les études menées sur l’évolution de quelques paramètres physico-chimiques (pH, sucres réducteurs, protéine brute, sucres totaux, degré alcoolique, densité primitive et extrait réel) et celle de la flore microbienne de la boisson Tangawisi I en maturation ont donné les résultats consignés dans les Tableaux 2 et 3.
Perspectives pour l’amélioration de la qualité des boissons Tangawisi
Pasteurisation
Les dénombrements des germes totaux sur gélose nutritive et des coliformes totaux sur le bouillon de MacConkey ont été réalisés : immédiatement après pasteurisation (analyse 1), deux semaines (analyse 2) et quatre semaines (analyse 3) après ce traitement et ont donné les valeurs consignées dans le Tableau 4.
La pasteurisation a réduit sensiblement la flore aérobie mésophile totale et les coliformes totaux; mais la conservation au froid de ces boissons a contribué aussi à la réduction de leur population selon le Tableau 4. L’analyse de ce tableau montre que la flore totale et les coliformes totaux dans les échantillons des deux boissons non traitées (T0) augmentent pendant toute la durée de l’étude. Les techniques de pasteurisation (basse PB et haute PH) ont contribué à la réduction de l’ordre de 99% de la flore microbienne initiale (flore totale et coliformes totaux). La conservation au froid des échantillons des deux boissons pasteurisées a contribué aussi à la réduction du nombre des microorganismes ayant survécu après la pasteurisation.
Séchage

L’appréciation de la couleur, de l’odeur et de l’arôme des trois boissons obtenues après macération de broyat humide, de broyat séché à l’étuve et au soleil est consignée dans le Tableau 5.
Le séchage est une des techniques largement utilisée pour la conservation des produits végétaux dans le but d’une utilisation ultérieure. Il entraîne la perte d’eau et la concentration d’autres substances [FRANÇOISE, 1995].
DISCUSSION
Selon les critères microbiologiques applicables aux jus [MUSTCH, 2015], les boissons I et II du Tableau 1 sont en dehors des normes (qualité insuffisante), par contre la boisson III et la boisson formulée sont dans les normes (qualité satisfaisante). La présence des germes totaux/levures est un signe d’altération très engagée due à l’évolution normale de cette flore endogène ; cette présence ne présente pas un risque de santé humaine mais peut refléter des mauvaises pratiques. Par contre la présence des coliformes fécaux et entérobactéries est un indice de la présence éventuelle des bactéries pathogènes [CHENOUF, 2014] et un risque pour la santé des consommateurs.
Les trois colonies caractéristiques des coliformes fécaux, isolées sur le milieu MacConkey au cristal violet et soumises à une galerie des tests biochimiques pour leur identification par similarité, appartiennent aux souches de : Enterobacter amnigenus, Enterobacter cloacae et Enterobacter aerogenes. Par contre les colonies isolées sur les milieux XLD agar et SS agar après enrichissement de la boisson II dans le bouillon au sélénite et soumises à une galerie des tests biochimiques pour leur identification par similarité appartiennent respectivement aux souches de : Klebsiella pneumoniae et Enterobacter intermedius pour XLD agar et aux souches de : Enterobacter agglomerans et Enterobacter intermedius pour SS agar.
Les entérobactéries se retrouvent en nombre très élevé dans d’autres boissons. Elles peuvent, de par leur nombre et/ou leurs enzymes, provoquer des infections chez les consommateurs, annihilant le bienfait attendu des substances que la boisson est censée leur apporter [GAZENGEL et ORECCHIONI, 2001 ; REICHL, 2002 ; PERRY et al., 2004].
Tableau 4| Nombre d’UFC de la flore totale et NPP de coliformes totaux par millilitre de 2 boissons Tangawisi (IV et V) soumises à la pasteurisation et conservées au froid pendant 28 jours
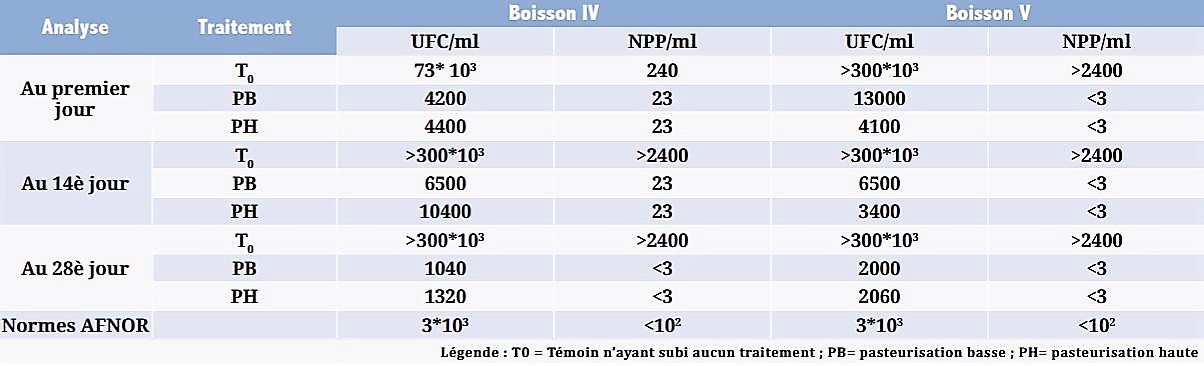
Tableau 5| Appréciation de la couleur, de l’odeur et de l’arôme des trois boissons Tangawisi obtenues après macération du broyat humide (non séché) et des broyats séchés au soleil et à l’étuve

La source de contamination de ces boissons Tangawisi se situe sans doute au niveau des matières premières utilisées pour la fabrication, c’est-à-dire l’eau et les organes végétaux utilisés. Les ustensiles de travail et l’hygiène corporelle du fabricant, de même que l’environnement de travail peuvent aussi constituer des sources non négligeables [FRANÇOISE, 1995 ; ANONYME, 1997].
Les organes végétaux sont aussi des abris des microorganismes du sol avec lesquels ils développent toutes sortes de relations. Leur exposition, à l’air libre, pendant le transport, le stockage et la vente, peut permettre aux microorganismes de l’atmosphère de s’installer et d’accroître leur charge microbienne. L’eau intervient dans le nettoyage des organes végétaux qui pour la plupart sont des racines extirpées du sol et qui entraînent une flore tellurique ; elle intervient aussi dans la solubilisation et l’extraction des principes actifs contenus dans les organes végétaux et est la matière première qui est utilisée en grande quantité [FRANÇOISE, 1995]. Les ustensiles de travail mal entretenus et une mauvaise hygiène corporelle du fabricant peuvent justifier, dans la boisson, la présence d’une flore microbienne parmi laquelle on peut retrouver des souches qui mutent et deviennent pathogènes.
CHENOUF et al. [2014] ont signalé la présence des levures et des coliformes dans les différents types des boissons rafraîchissantes sans alcool édulcorées commercialisées en Algérie. HABAMUBGU et al. [2014] n’ont pas observé la présence des microorganismes dans les échantillons des boissons locales nouvellement introduites et produites par la population du Sud-Kivu à cause du taux élevé d’alcool (20-25%).
En observant le Tableau 2, le constat est que la boisson Tangawisi analysée contient des éléments nutritifs (2,72% des protéines, 2,4% des sucres totaux et 0,15% des sucres réducteurs). La boisson Tangawisi n’est pas seulement stimulante mais elle est nutritive. Les proportions de ces nutriments diminuent avec le temps (au cours de la maturation) suite à l’activité des microorganismes contenus dans la boisson après sa fabrication dont le nombre augmente avec le temps selon le Tableau 3. Cette flore microbienne se sert des éléments nutritifs présents dans les boissons Tangawisi pour sa croissance. La multiplication de ces microorganismes est faible suite aux faibles quantités de nutriments et à la concurrence entre les groupes de microorganismes présents. Les bactéries se développent plus vite que les levures.
Les tests biochimiques de la galerie d’identification Enterosystème R18 appliqués sur une colonie caractéristique développée sur Chromatic-Salmonella agar révèle la présence d’une souche d’Enterobacter cloacae, une espèce des Entérobactéries.
Au cours de la maturation, il se passe diverses réactions biochimiques, qui impliquent l’utilisation des nutriments de la boisson Tangawisi par les microorganismes. La fermentation n’est pas l’exclusivité des levures, d’autres bactéries telles que les Entérobactéries, les bactéries lactiques, les Staphylocoques et même certaines moisissures peuvent, par divers processus fermentaires, produire des métabolites susceptibles de modifier la qualité de la boisson. L’acidification de la boisson suppose qu’il y a eu formation des métabolites susceptibles de baisser le pH (acides organiques) qui se sont formés au détriment des glucides et des protéines. Elle est le fait de la fermentation « acide mixte » par les Entérobactéries et les coliformes qui sont en grand nombre dans ces types de boisson [PERRY et al., 2004 ; MADIGAN et MARTINKO, 2007].
L’augmentation de l’extrait réel est une conséquence de l’hydrolyse des hydrates de carbone sous l’action enzymatique au cours de la maturation. Le distillat obtenu contient des composés organiques volatils dont l’éthanol et les huiles essentielles ; mais la constance de la valeur du degré alcoolique durant la maturation fait penser à d’autres composés organiques volatils autre que l’éthanol.
La pasteurisation est un traitement thermique par lequel on expose un produit à une température modérée (≤85°C) pendant une courte durée. De ce fait, seuls les microorganismes les plus sensibles à la chaleur sont détruits. Tous les microorganismes n’étant pas éliminés par la pasteurisation, ce traitement thermique doit être suivi d’un brusque refroidissement. Les aliments pasteurisés sont alors habituellement conservés au froid (+4°C) afin de ralentir le développement des germes encore présents. Ce procédé vise aussi la destruction des enzymes thermosensibles et le maintien de la qualité du produit [REGNAULT, 2002 ; PERRY et al., 2004 ; MADIGAN et MARTINKO, 2007].
L’étude menée par NDIAYE et al. [2015] a montré l’existence de la pasteurisation dans les procédés artisanaux de fabrication de boissons et de concentrés d’Hibiscus sabdariffa au Sénégal ; les résultats microbiologiques ont révélé une absence totale de bactéries pathogènes sur tout le procédé de transformation mais seulement la présence de flore aérobie mésophile totale, de levures et de moisissures. Le suivi microbiologique effectué sur un lot de production stocké à différentes températures (4, 10, 20, 30 et 37°C) pendant six mois a montré que le produit fini qui était salubre au départ présentait une certaine flore dont la quantité dépassait les valeurs seuils en vigueur.
Le séchage de broyats des matières premières des boissons Tangawisi ne peut être encouragé. En effet, le séchage au soleil ou à l’étuve de broyats des végétaux d’une boisson Tangawisi entraîne non seulement la perte d’eau mais aussi de substances odorantes, à telle enseigne que la boisson reconstituée par addition de l’eau perd son arôme, son goût et sa couleur caractéristique initiale. En effet, le broyage favorise l’éclatement de cellules qui contiennent des substances colorantes et des composés organiques volatils. Libérées de leurs cellules, les substances colorantes et les composés organiques volatils sont facilement emportés dans l’atmosphère sous l’effet de la convection.
La couleur, l’odeur et l’arôme caractéristiques des boissons Tangawisi proviennent des substances colorantes et des composés organiques volatils. Les composés organiques volatils, notamment les essences, peuvent être extraites par des techniques de séparation appropriées. Une autre voie de valorisation des végétaux des boissons Tangawisi est l’étude de leur fraction volatile contenant des composés organiques responsables de l’odeur et de l’arôme, spécialement les huiles essentielles eu égard à leur contribution en faveur de l’agro-alimentaire, de l’agriculture, de la cosmétique et de la santé.
Tous les végétaux utilisés dans la fabrication des produits Tangawisi contiennent des composés organiques volatiles dont les huiles essentielles. Certaines de ces huiles essentielles sont suffisamment documentées quant à leur composition chimique et leurs propriétés biologiques et pharmacologiques. C’est le cas de l’huile essentielle de : Zingiber officinalis [BHARGAVA et al., 2012 ; SHARREF et al., 2016], Aframomum melegueta et Piper guineense [ECHO et al., 2012], Mangifera indica [CHETAN et al., 2014 ; OLIVEIRA et al., 2017], Xylopia aethiopica et Monodora myristica [EZEKWESILI et al., 2010 ; BAKARNGA-VIA et al., 2014], Heinsia crinata [EBONG et al., 2014], Securidaca longepedunculata [NDAMITSO et al., 2013], Cyperus articulatus [OLAWORE et al., 2006].
L’utilisation des huiles essentielles des végétaux des produits Tangawisi peut être valorisée pour épargner les consommateurs des méfaits de la qualité hygiénique douteuse des produits issus des végétaux bruts, de l’eau et de la technologie mise en place. La fabrication des boissons et des miels aromatisés de composition connue en huiles essentielles [VALNET, 1990] peut être une voie de valorisation de ces végétaux au profit des consommateurs.
CONCLUSION
Les produits Tangawisi liquides (boissons Tangawisi) n’ont pas en général une bonne hygiène et peuvent représenter un risque pour la santé des consommateurs. Les végétaux utilisés pour leur fabrication constitueraient la principale source de contamination microbienne de ces boissons. Les nutriments apportés par les végétaux sont utilisés par les microorganismes lors de la maturation de la boisson. La pasteurisation peut être une voie par excellence pour l’amélioration de ces boissons. Le séchage de broyat des végétaux des boissons Tangawisi conduit à la perte des substances chimiques responsables de la couleur, de l’odeur et de l’arôme recherchées dans ces boissons. L’exploration de la voie d’utilisation des composés organiques volatiles, notamment, les huiles essentielles de ces végétaux à vertu thérapeutique, peut réduire ou annuler les risques liés à l’utilisation de matières végétales contaminées qui affectent la qualité hygiénique des produits Tangawisi.
RÉSUMÉ
Dans le but de mettre en évidence la qualité hygiénique des boissons Tangawisi fabriquées et vendues à Kinshasa et de proposer des perspectives en vue de leur amélioration, des analyses microbiologiques et physico-chimiques ont été effectuées. Les analyses effectuées montrent que ces boissons renferment des quantités importantes de microorganismes parmi lesquels les germes aérobies totaux, les coliformes totaux et fécaux, les entérobactéries pathogènes, la flore fongique, la flore lactique, les streptocoques fécaux et la flore mannitol positif. La maturation des boissons Tangawisi est un processus fermentaire de substrats glucidiques par les microorganismes. La pasteurisation améliore la qualité hygiénique de ces boissons ; le séchage de broyat des végétaux entraîne la perte des composés organiques volatils responsables de la couleur, de l’odeur et de l’arôme caractéristiques de ces boissons incluant les huiles essentielles.
Mots clés
Boisson Tangawisi, Gingembre, Qualité hygiénique, Pasteurisation, Séchage, Huile essentielle
REFERENCES ANONYME. [1997]. Agriculture, food and nutrition for Africa; F.A.O; Rome; 412 pages.
BADRELDIN H.A., GERALD B., MUSBAH O.T. and ABDERRAHIM N. [2008]. Some phytochemical, pharmacological and toxicological properties of ginger (Zingiber officinalis Roscoe): A review of recent research ; Elsevier ; Food and Chemical Toxicology 46: 409-420.
BAKARNGA-VIA I., HZOUNDA J.B., FOKOU P.V.T., TCHOKOUAHA L.R.Y., GARY-BOBO M., GARCIA A.G.M., WALBADET L., SECKA Y., DONGMO P.M.J., BOYOM F.F. and MENUT C. [2014]. Composition and cytotoxic activity of essential oils from Xylopia aethiopica (Dunal) A. Rich, Xylopia parviflora (A. Rich) Benth.) and Monodora myristica (Gaertn) growing in Chad and Cameroon. BMC Complementary and Alternative Medicine, 14:125-128.
BHARGAVA S., DHABHAI K., BATRA A., SHARMA A. and MALHOTRA B. [2012]. Zingiber Officinale: Chemical and phytochemical screening and evaluation of its antimicrobial activities. Journal of Chemical and Pharmaceutical Research, 4,1:360-364.
BIELSALSKI H.K. et GRIMM P. [2001]. Atlas de poche de nutrition. Editions Maloine ; Paris ; 341 pages.
BORGET M. [1991]. Les plantes tropicales à épices. Edition Maisonneuve et Larose et ACCT ; Paris : 143 pages.
BRUNETON J. [1999]. Pharmacognosie, Plantes médicinales. Editions Technique et documentation ; Paris ; 1120 pages.
CHENOUF A., KHIRANI A., YABRIR B., HAKEM A., LAHRECH B.M., HOUALI K. et CHENOUF N. [2014]. Risque dû à la consommation des boissons rafraichissantes sans alcool édulcorées. Afrique Sciences 10,4 : 70-77.
CHETAN S., KULKARNI A.R., MANNASAHEB B.A. and GAJARE R. [2014]. Immunomostimulant phytoconstituents from Mangifera indica L. bark oil. The Journal of Phytopharmacology 2014; 3,2: 139-148.
DAHOUENON-AHOUSSI E., RENE G.D., EULOGE S.A. et DOMINIQUE C.K.S. [2012]. Stabilisation de la bière produite à partir de matières amylacées locales (Sorghum bicolor et Musa acuminata) par adjonction de l’huile essentielle de Cymbopogon citratus. Journal of Applied Biosciences 51: 3596 – 3607.
EBONG P.E., IGILE G.O., MGBEJE B.I.A., IWARA I.A., ODONGO A.E; ONOFIOK U.L. and OSO E.A. [2014]. Hypoglycemic, Hepatoprotective and Nephroprotective Effects of Methanolic Leaf Extract of Heinsia crinita (Rubiaceae) in Alloxan-induced Diabetic Albino Wistar Rats. IOSR Journal of Pharmacy; 4, 1: 37-43.
ECHO I.A., OSUAGWU A.N., AGBOR R.B., OKPAKO E.C. and EKANEM B.E. [2012]. Phytochemical Composition of Aframomum melegueta and Piper guineense Seeds. World Journal of Applied Environmental Chemistry; 2, 1: 17-21.
EL-BAROTY G.S., ABD EL-BAKY H.H., FARAG R.S. and SALEH M.A. [2010]. Characterization of antioxidant and antimicrobial compounds of cinnamon and ginger essential oils; African Journal of Biochemistry Research 4, 6: 167-174.
EZEKWESILI C.N., NWODO O.F.C., ENEH F.U. and OGBUNUGAFOR H.A. [2010]. Investigation of the chemical composition and biological activity of Xylopia aethiopica Dunal (Annonacae). African Journal of Biotechnology 9,43 : 7352-7356.
FRANÇOISE M. [1995]. Transformer les fruits tropicaux. Editions GRET; Paris; 224 pages.
GAZENGEL J.M. et ORECCHIONI A.M. [2001]. Préparateur en pharmacie : Guide théorique et pratique. Editions Technique et documentation ; Paris ; 1073 pages.
HABAMUBGU S.S., KAZADI M., et KAFUMBA K.M. [2014]. Evaluation chimique et microbiologique des boissons locales nouvellement introduites et produites par la population du Sud-Kivu: cas des groupements de KATANA et BUGORHE. International Journal of Innovation and Applied Studies, 8, 2, 736-742.
KAMBU K. [1990]. Eléments de phytothérapie comparée ; Plantes médicinales africaines ; Centre de recherche pédagogique ; Collection U (U31) ; Kinshasa ; 106 pages.
LATHAM P. et KONDA K.M. [2006]. Quelques plantes utiles de la Province du Bas-Congo province, République Démocratique du Congo. 2è édition. 330 pages.
MADIGAN M. et MARTINKO M. [2007]. Brock Biologie des microorganismes ; 11è édition ; Editions Pearson Education ; Paris ; 1047 pages.
MUSTCH L. [2015]. Critères microbiologiques applicables aux denrées alimentaires-Lignes directrices pour leur interprétation. Ministère de Santé, Grand-Duché de Luxembourg. 59 pages.
NGBOLUA K.N., MIHIGO S.O., LIYONGO C.I., ASHANDE M.C., TSHIBANGU D.S.T., ZOAWE B.G., BAHOLY R., FATIANY P.R. and MPIANA P.T. [2016]. Ethno-botanical survey of plant species used in traditional medicine in Kinshasa city (Democratic Republic of the Congo). Tropical Plant Research 3, 2: 413–427.
NDAMITSO M.M., MOHAMMED A., JIMOH T.O., IDRIS S., OYELEKE S.B. and ETSUYANKPA M.B. [2013]. Phytochemical and antibacterial activity of Securidaca longepedunculata on selected pathogens. African Journal of Microbiology Research. 7, 50 : 5652-5656.
NDIAYE N.A, DIENG M., KANE A., CISSE M., MONTET D. et TOURE N.C. [2015]. Diagnostic et caractérisation microbiologique des procédés artisanaux de fabrication de boissons et de concentrés d’Hibiscus sabdariffa L au Sénégal. Afrique SCIENCE 11, 3 : 197 – 210.
NZUKI B.F., TERMOTE C., KIBUNGU K. et VAN DAMME P. [2013]. Identification et importance locale des plantes médicinales utilisées dans la région de Mbanza-Ngungu, République Démocratique du Congo. Bois et Forêts des Tropiques, 316 , 2 : 64-77.
OLAWORE N.O., LAMIDI A.U., ISIAKA A.O. and KASALI A.A. [2006]. Constituents of Rhizome Essential Oils of Two Types of Cyperus articulatus L. Grown in Nigeria. Journal of Essential Oil Research. 18, 6: 604-606.
OLIVEIRA R.M, DUTRA T.S, SIMIONATTO E., RÉ N., KASSUYA C.A.L. and CARDOSO C.A.L. [2017]. Anti-inflammatory effects of essential oils from Mangifera indica. Genetics and Molecular Research 16 (1), 9 .
PERRY J.J., STALEY J.T. et LORY S. [2004]. Microbiologie : cours et questions de révision ; Edition Dunod ; Paris ; 891 pages.
PRESCOTT L., HARTLEY J.P. et KLEIN D.A. [2003]. Microbiologie. 2ème édition française. Editions De Boeck Université. Bruxelles. 978 pages. REGNAULT J. [2002]. Eléments de microbiologie et d’immunologie ; Edition Décarie, Québec, 498 pages.
REICHL F.X. [2002]. Atlas de poche de Médecine de l’environnement. Editions Maloine; Paris; 366 pages.
SCHMELZER G.H. et GURIB-FAKIM A. [2008]. Ressources végétales de l’Afrique tropicale 11 (1) : Plantes médicinales 1. Editions Prota-CTABackhys Publishers ; Wageningen ; 869 pages.
SHAREEF H.K., MUHAMMED H.J., HUSSEIN H.M. and HAMEED I.H. [2016]. Antibacterial Effect of Ginger (Zingiber officinale) Roscoe and Bioactive Chemical Analysis using Gas Chromatography Mass Spectrum. Oriental Journal of Chemistry; 32, 2: 817-837.
VALNET J. [1990]. Aromathérapie, Traitement des maladies par les essences des plantes, Editions Maloine, 11è édition, Paris, 468 pages.
WOLDU A.R. et TSIGIE Y.A. [2015]. Optimization of Hydrolysis for Reduced Sugar Determination from Avocado Seed Wastes. American Journal of Environment, Energy and Power Research; 3, 1: 1 – 10.
© 2018 ACASTI and CEDESURK Online Journal
Les bienfaits santé du gingembre

La consommation du gingembre protège contre les cancers et les maladies cardiovasculaires selon une étude publiée à la faculté des sciences agronomiques de l’Université de Kinshasa (UNIKIN).
Selon cette étude, le gingembre est consommé aux quatre coins du monde pour soulager différents maux tels que les rhumatismes, les nausées, le rhume et les maux de tête, il peut être également utilisé sous différentes formes, comme en capsules, en poudre, en tisanes, frais ou en sirop.
Cette étude a fait savoir que les antioxydants sont des composés qui protègent les cellules du corps des dommages causés par les radicaux libres. Ces derniers sont des molécules très réactives qui seraient impliquées dans le développement des maladies cardiovasculaires, de certains cancers et d’autres maladies liées au vieillissement.
Une quarantaine de composés antioxydants ont été découverts dans le gingembre. Certains d’entre eux seraient résistants à la chaleur et pourraient même être libérés durant la cuisson, ce qui pourrait expliquer l’augmentation de l’activité antioxydant du gingembre cuit.
Le gingembre moulu se situe au troisième rang quant à son contenu en antioxydants parmi de nombreux aliments. Le gingembre frais possède aussi une forte activité antioxydante comparativement à d’autres légumes et épices consommés.
En consommant du gingembre avec de l’ail ou de l’oignon (ou mieux encore, les deux), on créerait une synergie entre leurs différents composés antioxydants. Ce qui leur permettrait de surpasser leurs effets antioxydants individuels.
YWM/Fmb
Date de dernière mise à jour : lundi, 17 décembre 2018
Ajouter un commentaire

